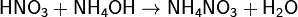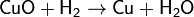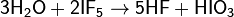Milyen anyag a víz?

A víz egy szervetlen vegyület, amely a következőkből áll:oxigénből és hidrogénből. Normál körülmények között színtelen, átlátszó folyadék, melynek nincs szaga és íze. Szilárd formában a víz hó, jég vagy fagy, és gáznemű formában, gőz. A bolygó felszínének megközelítőleg 71% -a vízzel van lefedve. A vízkészletek mintegy 96% -aa óceánokra esik, míg a fennmaradó 4% -ot tavak, gleccserek, mocsarak és talajvíz borítja. Természetéből adódóan a víz kiváló oldószer, és összetételében mindig tartalmaz oldott anyagokat vagy gázokat, kivéve a desztillált vizet. A víz a bolygó legfontosabb életforrása. Ezért ebben a cikkben megpróbáljuk elmondani mindent ennek a csodálatos anyagnak, és ami a legfontosabb, milyen anyag a víz a természet és milyen kémiai és fizikai tulajdonságai vannak.
A víz fizikai tulajdonságai
- Normál légköri körülmények között vízmegtartja a folyékony állapotot, miközben a hasonló terv többi hidrogénvegyületét gázok alkotják. Ez a jelenség a molekulák és a vízatomok hozzáadásának sajátos tulajdonságai és a köztük lévő kötések következménye. Az oxigénatomok hidrogénatomhoz kapcsolódnak, közel 105 fok szöget zárnak be, és ez a konfiguráció mindig megmarad. Az oxigén és a hidrogénatomok elektronegativitásának nagy különbségén keresztül az elektronfelhők erősen eltolódnak az oxigén felé. Ebben az összefüggésben a vízmolekulát aktív dipólusnak tekintjük, amelyben a hidrogén oldal pozitív töltésű, és az oxigén oldala negatív. Ennek eredményeként a vízmolekula kötéseket hoz létre, elég nehéz felbomlani, és sok energiát igényel.
- A víz gyakorlatilag nem engedheti meg magát. Így a légköri nyomás egy bárral történő növelésével a vizet csak 0,00005 részből tömörítik az eredeti térfogatából.
- A jég és a víz szerkezete nagyon hasonló. Mind jégben, mind vízben a molekulák bizonyos rendben hajlamosak telepedni - szerkezetet akarnak létrehozni, de a termikus mozgás megakadályozza. Amikor a víz szilárd állapotba kerül, a molekulák termikus forgása már nem akadályozza a szerkezeti kialakulást, majd a molekulákat rendezik, és a köztük lévő üregek nőnek, ami következésképpen csökkenti a sűrűséget. Ez magyarázza azt a pontot, hogy a víz nagyon kóros anyag. A víz szilárd aggregált állapota jég, biztonságosan úszhat a víz folyékony aggregátumának felületén. Ha párologtatás történik, ellenkezőleg, minden csatlakozás azonnal megtörik. Ezeknek a kötéseknek a megtörése jelentős mennyiségű energiát igényel, ami megmagyarázza a víz legnagyobb hőkapacitását az összes anyag között. Egy liter víz 1 literes felmelegítéséhez 4 kJ energiát kell töltenie. Ennek a tulajdonságnak köszönhetően a vizet gyakran hűtőfolyadékként használják.
- A víz magas felületi feszültséggel rendelkezik,így csak a higany jelenik meg ebben a mutatóban. A víz magas viszkozitása hidrogénkötéseknek köszönhető, amelyek megakadályozzák a molekulák különböző sebességű mozgását.
- A víz jó oldószer. Az oldott anyag molekuláit azonnal vízmolekulák veszik körül. Az oldott anyag pozitív részecskéit oxigénatomok vonzzák, és a negatív részecskéket a hidrogénatomok vonzzák. Mivel a vízmolekulák mérete elég kicsi, az oldott anyagok mindegyike azonnal nagy mennyiségű vízmolekulát képes körülveszíteni.
- A víz olyan anyag, amely negatív elektromos potenciállal rendelkezik a felületen.
- Tiszta formájában a víz jó szigetelő,De mivel gyakran ezek vagy más anyagok, sók vagy savak feloldódnak, akkor mindig vannak negatív és pozitív ionok a vízben. Ezeknek a tulajdonságoknak köszönhetően a víz vezethet villamos energiát.
- A víz törésmutatója n = 1,33. De a víz tökéletesen elnyeli az infravörös sugárzást, és ezzel a tulajdonsággal kapcsolatban a víz, pontosabban a vízgőz, egy üvegházgáz. Továbbá a víz alkalmas mikrohullámú sugárzás elnyelésére, amelyen a mikrohullámú sütők hatása alapul.
Kémiai tulajdonságok
Azok, akik úgy vélik, hogy a víz szerves anyag, erősen tévednek. A vizet két elem alkotja: oxigén és hidrogén. Ezután megfontoljuk a víz fő kémiai tulajdonságait.
A következő reakciókhoz vizet kaphat:
A semlegesítési reakció során is:
A réz-oxid hidrogénnel történő redukálásával:
Szobahőmérsékleten a víz reagál:
Aktív fémekkel:
Fluor- és halogénvegyületekkel:
Gyenge bázis és gyenge sav képzõdõ sói, miközben ezek hidrolízisét okozzák:

- Halogén-anhidridekkel és szervetlen és karbonsav-anhidridekkel.
- A szerves fémvegyületek (Grignard reagensek, dietil-cink, metil-nátrium).
- Nitridek, karbidok, foszfidek, hidridek, alkálifém-szilicidek.
- A legtöbb sóval a hidrát képződése mellett.
- Silánokkal és boránokkal.
- A szén nokisyu és ketén.
- Nemesgázok fluoridjaival.
Fűtött, reagál magnéziummal, vasal:
Metán és szén:
Katalizátorok jelenlétében reagál:
- Éterekkel és amidokkal.
- Az alkinokkal.
- Nitrilekkel.
- Alkénekkel.
Remélem, hogy a mi cikkünk segített abban, hogy megértsük, mi az anyag a víz, és most már többet tudsz róla.